CRISTALES LÍQUIDOS. GENERALIDADES
Los científicos han estudiado los tres estados de la materia durante doscientos años, pudiéndose considerar el estado líquido cristalino como el cuarto estado. Esta fase se puede conseguir en el laboratorio por calentamiento de ciertas moléculas o por mezcla de varios componentes.
Cada sustancia posee fuerzas moleculares de algún tipo, siendo éstas diferentes en cada una de las fases de la materia, por lo que causan en cada caso una fase distinta estable a la misma temperatura.
La palabra cambio de fase simboliza el paso de una fase a otra debido a un cambio de temperatura. Se dice entonces que una transición de fase ha ocurrido a esa temperatura. El cambio importante que tiene lugar en una transición es la cantidad de orden entre las moléculas de la sustancia.
TIPOS DE CRISTALES LÍQUIDOS
TERMOTRÓPICOS
Los cristales líquidos termotrópicos están formados por una sustancia pura que en un intervalo de temperaturas presentan una mesofase. A temperaturas inferiores la muestra es sólida y a temperaturas superiores es un líquido isotrópico. Lo que caracteriza a este grupo son las moléculas alargadas. Estos cristales líquidos se pueden dividir en tres clases: nemáticos, esmécticos y colestéricos.

ESMÉCTICOS
En un cristal líquido esméctico, las moléculas tienen una relativa libertad de traslación sobre los ejes X e Y de rotación sobre el eje Z. Las fuerzas laterales entre las moléculas de la fase esméctica son más fuertes que las fuerzas entre las capas y por eso es posible el deslizamiento de una capa sobre otra que proporciona la fluidez característica del sistema, sin perder el orden dentro de la capa.
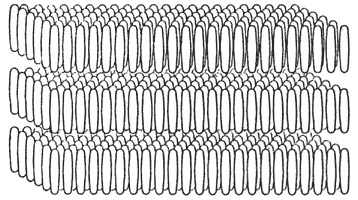
COLESTÉRICOS
La estructura colestérica-nemática fue observada por primera vez con ésteres colestéricos. Cualquier cristal líquido nemático común puede convertirse en uno colestérico añadiendo un componente ópticamente activo. En los últimos años se han encontrado moléculas que no son ésteres, que son activas ópticamente y que muestran estructura colestérica-nemática. Para distinguir estos compuestos de los ésteres colestéricos, llamaremos a estos cristales líquidos nemáticos quirales.
Partiendo de la estructura nemática podemos obtener un cristal líquido colestérico si se supone que la orientación de las moléculas dentro de las capas sucesivas va girando a medida que avanzamos en el eje Y. Las moléculas dentro de una capa tienen la misma orientación, pero ésta varía describiendo un estructura helicoidal a medida que se avanza en una dirección perpendicular a las capas moleculares.
En esta fase de cristal líquido el director no está fijo en el espacio como en una fase nemática; sino que rota a través de la muestra.
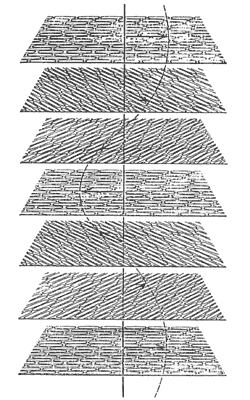
LIOTRÓPICOS
Las moléculas que forman cristales líquidos liotrópicos son agentes tensioactivos que constan de dos partes distintas: una polar, a menudo iónica, que es la cabeza y otra no polar, a menudo una cola hidrocarbonada.
Las moléculas de cristal líquido liotrópicas pertenecen a una clase de sustancias llamadas compuestos anfifílicos. Estos compuestos tienen una cabeza polar (iónica) hidrofílica y una cola hidrofóbica.
Estos cristales líquidos se forman cuando un sólido se disuelve en un líquido apropiado a intervalos determinados de concentración, temperatura y presión. A medida que aumenta la concentración de las moléculas en la solución, ellas toman diferentes ordenamientos o fases.
La forma cristalina de una molécula anfifílica y agua genera una serie de estructuras desde el cristal hasta la solución verdadera. Con algunas combinaciones, las mesofases polimórficas formadas mostrarán empaquetamiento molecular laminar (empaquetamiento en capas), empaquetamiento molecular cúbico, y empaquetamiento molecular hexagonal.
Jabones y detergentes dan cristales líquidos liotrópicos cuando se combinan con agua. Lo que es más importante es que las membranas biológicas muestran comportamiento de cristal líquido liotrópico.
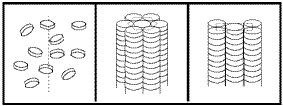
MICELAR
A bajas concentraciones, la solución parece como cualquier otra, partículas de soluto distribuidas de forma aleatoria por toda el agua. Cuando la concentración se hace lo suficientemente elevada, las moléculas comienzan a ordenarse en esferas huecas, varillas, y discos llamados micelas.
La superficie de una micela es una capa de cabezas polares disueltas en agua, mientras que la parte interna está compuesta de colas hidrofóbicas separadas del agua por las cabezas hidrofílicas.

BICAPA
Esta estructura tiene una doble capa de moléculas ordenadas como un sándwich con las cabezas polares ocupando el lugar del pan y las colas no polares como el relleno.

Fase bicapa.
VESÍCULA
Las vesículas son bicapas que se han plegado en una estructura esférica tridimensional, una especie de micela con dos capas de moléculas. Las moléculas que forman vesículas normalmente tienen una cabeza y doble cola o cadena. Los lípidos que se encuentran en las membranas celulares forman espontáneamente vesículas cuando se encuentran en solución.
. POLÍMEROS
Los polímeros son una clase de materiales que constan de muchas moléculas pequeñas (llamadas monómeros) que se pueden unir para formar largas cadenas, conociéndose éstas como macromoléculas. Los enlaces químicos conectan los monómeros en el polímero. Un polímero típico puede incluir decenas de miles de monómeros. Debido a su gran tamaño, los polímeros se pueden clasificar como macromoléculas.
El monómero puede sólo constar de unos pocos átomos o su estructura puede ser más compleja. El número de monómeros posible es extremadamente grande, lo que significa que se pueden producir muchos polímeros diferentes.
. POLÍMEROS
Los polímeros son una clase de materiales que constan de muchas moléculas pequeñas (llamadas monómeros) que se pueden unir para formar largas cadenas, conociéndose éstas como macromoléculas. Los enlaces químicos conectan los monómeros en el polímero. Un polímero típico puede incluir decenas de miles de monómeros. Debido a su gran tamaño, los polímeros se pueden clasificar como macromoléculas.
El monómero puede sólo constar de unos pocos átomos o su estructura puede ser más compleja. El número de monómeros posible es extremadamente grande, lo que significa que se pueden producir muchos polímeros diferentes.


la informacion me parecio muy bien ya que trataron los temas relacionados con la nanociencia y creo que esta bien su diseño y elaborado.... muy bien....¡¡¡
ResponderEliminar__Nancy Sanchez___grupo:524__
Este comentario ha sido eliminado por el autor.
ResponderEliminarMi comentario es que el blog está bien de información, con hipervínculos además de que me han enseñado sobre los cristales lípidos, ya que no sabía nada de este tema muy buen blog.
ResponderEliminarSoy: Saldivar Peña Mauricio
GRUPO:524